🎯 Ziel des Experiments
In diesem Experiment untersuchst du eine galvanische Zelle. Du erklärst die Umwandlung von chemischer Energie in elektrische Energie auf Teilchenebene.
🧠 Theoretischer Hintergrund
Eine galvanische Zelle besteht aus zwei räumlich getrennten Halbzellen, in denen eine Oxidation und eine Reduktion ablaufen. Die Elektronen werden über einen äußeren Stromkreis geleitet.
Daniell-Element:
Zn | Zn²⁺ || Cu²⁺ | Cu
🧰 Materialien (pro Gruppe)
- Zinkblech
- Kupferblech
- Becherglas mit Zinksulfatlösung (≈ 0,5 M)
- Becherglas mit Kupfersulfatlösung (≈ 0,5 M)
- Salzbrücke (U-Rohr mit KNO₃ oder getränktes Filterpapier)
- Voltmeter
- Kabel mit Krokodilklemmen
⚠️ Sicherheitshinweise
- Schutzbrille tragen
- Kupfersulfat ist gesundheitsschädlich
- Lösungen nicht verschütten
- Hände nach dem Experiment waschen
🔬 Versuchsaufbau
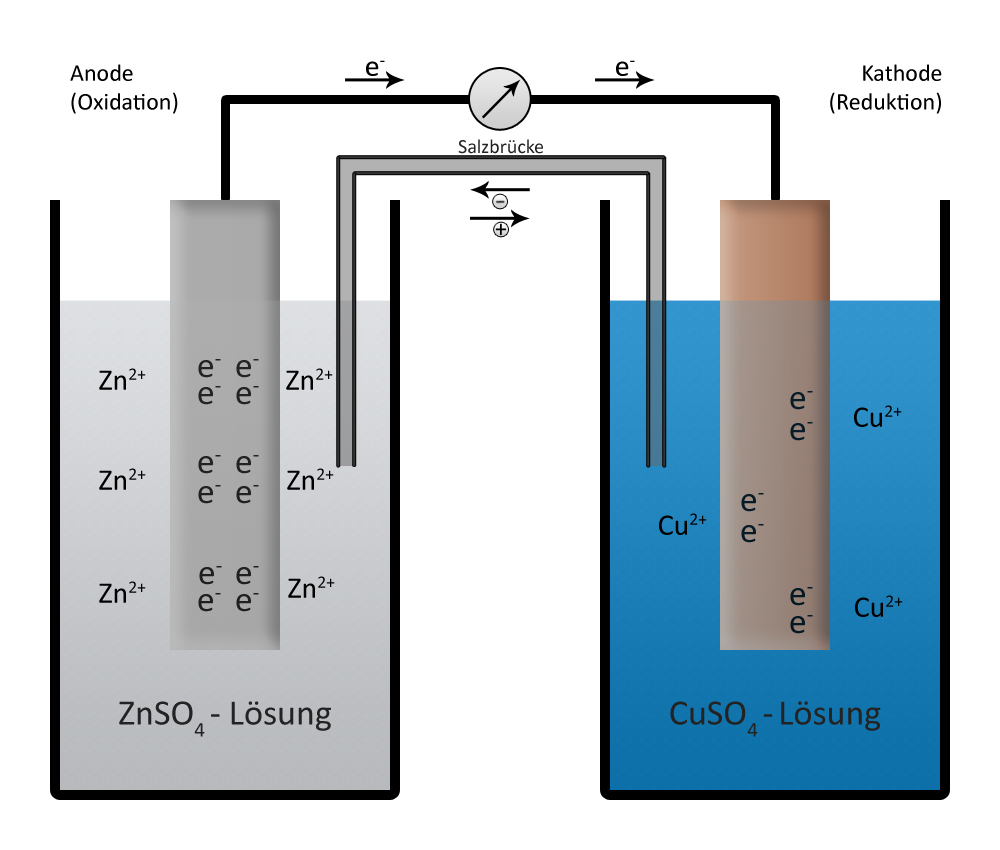
Stelle zwei Bechergläser nebeneinander auf und fülle sie jeweils mit einer Metallsalzlösung. Die Lösungen werden über eine Salzbrücke verbunden.
▶️ Durchführung
1️⃣ Vorbereitung
Stelle zwei Bechergläser nebeneinander auf und fülle eines mit Zinksulfatlösung, das andere mit Kupfersulfatlösung.
2️⃣ Elektroden einsetzen
Tauche das Zinkblech in die Zinksulfatlösung und das Kupferblech in die Kupfersulfatlösung.
3️⃣ Salzbrücke einsetzen
Verbinde beide Lösungen mithilfe der Salzbrücke. Achte darauf, dass beide Enden gut in die Lösungen eintauchen.
4️⃣ Stromkreis schließen
Verbinde die Zinkelektrode mit dem Minuspol und die Kupferelektrode mit dem Pluspol des Voltmeters.
5️⃣ Messung
Lies die Spannung ab und notiere den Messwert.
👀 Beobachtungen
🧪 Auswertung
🧠 Leitfragen zur Vertiefung
- Warum fließen Elektronen nur im äußeren Stromkreis?
- Welche Aufgabe übernimmt die Salzbrücke?
- Warum handelt es sich um eine galvanische Zelle?
- Wie hängt die gemessene Spannung mit der Spannungsreihe zusammen?
📸 Digitale Dokumentation
- Foto des Versuchsaufbaus
- Screenshot des Messwerts
- Digitale Auswertung im Arbeitsblatt oder Protokoll